更新时间:2023-03-02 11:06:31作者:潘星教育网阅读量:67
.热力学第一定律ΔU=Q+W 只适用于( )
(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化 答案:D
2.关于热和功, 下面的说法中, 不正确的是
(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上
(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义
(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量
(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消 答案:B

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.与物质的生成热有关的下列表述中不正确的是( )
(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量
(D) 通常所使用的物质的标准生成热数据实际上都是相对值 答案:A。按规定,标准态下最稳定单质的生成热为零。
.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是( )
(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程
(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程 答案:D
.下列过程中, 系统内能变化不为零的是( )
(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程
答案:D。因液体分子与气体分子之间的相互作用力是不同的故内能不同。另外,向真空蒸发是不做功的,W=0,故由热力学第一定律ΔU=Q+W得ΔU=Q,蒸发过程需吸热Q>0,故ΔU>0。
.第一类永动机不能制造成功的原因是( )
(A) 能量不能创造也不能消灭 (B) 实际过程中功的损失无法避免 (C) 能量传递的形式只有热和功 (D) 热不能全部转换成功
答案:A
.盖斯定律包含了两个重要问题, 即( )
(A) 热力学第一定律和热力学第三定律 (B) 热力学第一定律及热的基本性质
(C) 热力学第三定律及热的基本性质 (D) 热力学第一定律及状态函数的基本特征 答案:D

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.下面的说法符合热力学第一定律的是( )
(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化
(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关
(C) 封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关
(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关
答案:C。因绝热时ΔU=Q+W=W。(A)中无热交换、无体积功故ΔU=Q+W=0。(B)在无功过程中ΔU=Q,说明始末态相同热有定值,并不说明内能的变化与过程有关。(D)中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。
.关于热平衡, 下列说法中正确的是( )
(A) 系统处于热平衡时, 系统的温度一定等于环境的温度 (B)并不是所有热力学平衡系统都必须满足热平衡的条件
(C) 若系统A与B成热平衡, B与C成热平衡, 则A与C直接接触时也一定成热平衡
(D) 在等温过程中系统始终处于热平衡
答案:C。(A)中系统处于热平衡时,若为绝热系统则系统的温度与环境无关,故不一定等于环境温度。(D)等温过程中,系统不一定处于热平衡中。例如,A的温度大于B,A向B传热,而B向外散热。若传入B的热与从B散去的热相等,则B的温度不变,为一等温过程,但A与B之间却并没有达到热平衡。
.关于节流膨胀, 下列说法正确的是
(A)节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔塞两边的压力不断变化 答案:B
.在一个循环过程中,物系经历了i步变化,则
(A) ∑Qi=0 (B) ∑Qi-∑Wi=0 (C) ∑Wi=0 (D) ∑Qi+∑Wi=0 答案:D。因为ΔU=∑Qi+∑Wi,循环过程ΔU=0。
.与物质的燃烧热有关的下列表述中不正确的是
(A) 可燃性物质的燃烧热都不为零 (B) 物质的燃烧热都可测定,所以物质的标准摩尔燃烧焓不是相对值
(C) 同一可燃性物质处于不同状态时,其燃烧热不同 (D) 同一可燃性物质处于不同温度下,其燃烧热之值不同 答案:B。
.关于基尔霍夫定律适用的条件,确切地说是
(A) 等容条件下的化学反应过程 (B) 等压条件下的化学反应过程 (C) 等压或等容且不做非体积功的化学反应过程
(D) 纯物质在不同温度下的可逆相变过程和等压反应过程 答案:C
.关于热力学可逆过程,下面的说法中不正确的是
(A) 可逆过程不一定是循环过程 (B) 在等温可逆过程中,系统做功时,系统损失的能量最小
(C) 在等温可逆过程中,环境做功时,系统得到的功最小 (D) 可逆过程中的任何一个中间态都可从正逆两个方向到达
答案:B。因可逆过程系统做最大功,故系统损失的能量最大。
.理想气体自由膨胀与范德华气体绝热自由膨胀的区别在于范德华气体经绝热自由膨胀后
(A) ΔH≠0 (B) W=0 (C) ΔU≠0 (D) Q=0 答案:A。上述两过程因绝热和不做功故W与Q均为零。于是ΔU亦均为零。理想气体自由膨胀的焓未变,但范德华气体绝热自由膨胀的焓却不等于零。因为真实气体的焓不仅是温度的函数也是压力或体积的函数。
.如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有:

添加图片注释,不超过 140 字(可选)
(A) W =0, Q <0, DU <0 (B). W>0, Q <0, DU >0
(C) W <0, Q <0, DU >0 (D). W <0, Q =0, DU >0
答案:B。电阻丝得到电功,故W>0;电功全部转化为热并部分传给水,故Q<0;电阻丝仍有部分热没有传给水,故DU>0。
.如图,用隔板将刚性绝热壁容器分成两半,两边充入压力不等的空气(视为理想气体),已知p右> p左,将隔板抽去后:

添加图片注释,不超过 140 字(可选)
(A) Q =0, W =0, DU =0 (B) Q=0, W <0, DU >0 (C). Q >0, W <0, DU >0 (D) DU =0, Q=W ¹0
答案:A。因系统为恒容绝热,Q=W=0,故DU=0。
.对于理想气体,下列关系中哪个是不正确的:

编辑
添加图片注释,不超过 140 字(可选)
答案:A。理想气体的内能只是温度的函数。
.凡是在孤立体系中进行的变化,其DU 和DH 的值一定是:
(A)DU >0, DH >0 (B)DU =0, DH =0 (C) DU <0, DH <0 (D)DU =0,DH 大于、小于或等于零不能确定。 答案:D。
.在实际气体的节流膨胀过程中,哪一组描述是正确的:
(A)Q >0, DH =0, Dp < 0 (B)Q =0, DH <0, Dp >0 (C)Q =0, DH =0, Dp <0 (D)Q <0, DH =0, Dp <0
答案:C。节流膨胀过程恒焓绝热且压力降低。
.DH =Qp此式适用于哪一个过程:
(A)理想气体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5Pa (B)在0℃、101325Pa下,冰融化成水
(C)电解CuSO4的水溶液 (D)气体从(298K,101325Pa)可逆变化到(373K,10132.5Pa )
答案:B。DH =Qp成立的条件是恒压、W’=0。
.一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1、V2。
(A) V1 < V2 (B) V1 = V2 (C) V1 > V2 (D) 无法确定
答案:C(因绝热过程无法从环境吸热,则同样温度下压力较低,体积较小。)
. 某化学反应在恒压、绝热和只作体积功的条件下进行,体系温度由T1升高到T2,则此过程的焓变DH:
(A小于零 (B)大于零(C)等于零(D)不能确定 答案:C。因恒压、不做其它功,DH=Qp,又因绝热故DH=0。
.下图为某气体的p-V 图。图中A→B为恒温可逆变化,A→C为绝热可逆变化,A→D为多方不可逆变化。B, C, D态的体积相等。问下述关系中哪一个错误?

编辑
添加图片注释,不超过 140 字(可选)
(A) TB > TC (B)TC > TD (C)TB > TD (D)TD > TC 答案:B
.在体系温度恒定的变化过程中,体系与环境之间:
(A)一定产生热交换 (B)一定不产生热交换
(C)不一定产生热交换 (D)温度恒定与热交换无关 答案:C。例如,理想气体自由膨胀为恒温过程,W=0,Q=0。
. 某绝热封闭体系在接受了环境所做的功后,其温度:
(A)一定升高 (B)一定降低 (C)一定不变 (D)不一定改变 答案:A
.体系的状态改变了,其内能值:
(A)必定改变 (B) 必定不变 (C) 不一定改变 (D) 状态与内能无关 答案:C。例如,理想气体恒温下体积发生变化其内能不变。
.在一定T、p下,气化焓DvapH ,熔化焓DfusH 和升华焓DsubH 的关系:
(A) DsubH > DvapH (B) DsubH > DfusH (C) DsubH = DvapH +DfusH (D) DvapH > DsubH 答案:D
.一可逆热机与一不可逆热机在其它条件都相同时, 燃烧等量的燃料, 则可逆热机牵引的列车行走的距离:
(A) 较长 (B) 较短 (C) 一样 (D) 不一定 答案:A
.封闭体系中,有一个状态函数保持恒定的变化途径是什么途径?
(A)一定是可逆途径 (B)一定是不可逆途径 (C)不一定是可逆途径 (D)体系没有产生变化 答案:C
.某体系在非等压过程中加热,吸热Q,使温度从T1升到T2,则此过程的焓增量DH :
(A)DH = Q (B)DH = 0 (C)DH = DU +D(pV) (D)DH 等于别的值。 答案:C
.非理想气体进行绝热自由膨胀时,下述答案中哪一个错误:
(A)Q = 0 (B)W = 0 (C)DU = 0 (D)DH = 0 答案:D
.下述哪一种说法正确:
(A)理想气体的焦耳-汤姆逊系数μ不一定为零 (B)非理想气体的焦耳-汤姆逊系数μ一定不为零
(C)理想气体不能用作电冰箱的工作介质 (D)使非理想气体的焦耳-汤姆逊系数μ为零的p, T值只有一组
答案:C。因理想气体的焦耳-汤姆逊系数等于零,膨胀后不能致冷,故不能用作冰箱的工作介质。
.欲测定有机物的燃烧热Qp ,一般使反应在氧弹中进行,实测得热效为QV。由公式得:Qp = QV + ΔnRT = QV + pΔV,式中p应为何值?
(A)氧弹中氧气压力 (B)钢瓶中氧气压力 (C) p$ (D) 实验室大气压力 答案:D
.下述说法何者正确:
(A)水的生成热即是氧气的燃烧热 (B)水蒸汽的生成热即是氧气的燃烧热 (C)水的生成热即是氢气的燃烧热 (D)水蒸汽的生成热即是氢气的燃烧热 答案:C
.一恒压反应体系,若产物与反应物的ΔCp >0,则此反应:
(A)吸热 (B)放热 (C)无热效应 (D)吸放热不能肯定 答案:D
;问答题.对理想气体来说ΔUT=0,是否说明若水蒸气为理想气体则在25℃下将水蒸发成水蒸气时ΔUT=0?
答:温度不变内能则不变的说法只是对理想气体才适用。水蒸发变为水蒸气不符合此条件,故不成立。实际上水蒸发过程需吸收热量q=ΔU-W,可见所吸之热一部分对外做功,一部分使内能增加。
.说明下列有关功的计算公式的使用条件。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.理想气体恒温条件下反抗恒外压膨胀,则
(1)ΔH=ΔU+Δ(pV),ΔU=0,Δ(pV)=0,故ΔH=0 (2)ΔH=ΔU+pΔV,ΔU=0,pΔV≠0,故ΔH≠0
上面两个考虑问题的方法哪个是正确的?
答:方法(1)是正确的。理想气体内能只是温度的函数,因恒温故ΔU=0,理想气体恒温下pV=nRT为常数,故Δ(pV)=0。方法(2)的错误在于H=U+pV中的p 是指系统的压力。在反抗恒外压膨胀过程中,系统的压力既不是常数亦不等于外压,因此不能认为Δ(pV)=pΔV。
.系统经一个循环后,ΔH、ΔU、Q、W是否皆等于零?
答:否。其中H和U为状态函数,系统恢复至原态后其值复原,即ΔH=0、ΔU=0。而热与功是与途径有关的函数,一般不会正好抵消而复原,除非在特定条件下,例如可逆绝热膨胀后又可逆绝热压缩回至原态,或可逆恒温膨胀后又可逆恒温压缩回至原态等。
.理想气体从p1绝热膨胀至p2时,W=ΔU,绝热膨胀时若外压为零则W=0,ΔU=0;若外压不为零则ΔU≠0。以上两ΔU不相等与U为状态函数的性质是否矛盾?
答:不矛盾。在本例中,从同一始态出发进行绝热膨胀,若外压不同则终态是不可能相同的。因此ΔU亦不会相同。若外压不等于零时,系统的内能要消耗一部分用以转化为功,同时系统的温度要下降;当外压等于零时,系统不对外做功,不消耗内能故ΔU=0,同时系统的温度也不变。
. 25℃101.325Kpa下Cu-Zn电池放电做功时放热4561J。问些反应的ΔH是否就是4561J?
答:否。Qp=ΔH的条件是恒压、只做体积功。此电池放电时做出电功,不符合上述条件,故ΔH≠Qp。
.25℃100KPa下液态氮的标准摩尔生成热

编辑
添加图片注释,不超过 140 字(可选)
为零吗?
答:否。因为按规定只有25℃100Kpa下最稳定的单质的标准摩尔生成热才为零。液态氮虽为单质,但在25℃100Kpa下不能稳定存在,故其

编辑
添加图片注释,不超过 140 字(可选)
不等于零。只有气态氮的

编辑
添加图片注释,不超过 140 字(可选)
才为零。
.下面的说法是否正确,并说明理由?
(1)系统的焓等于等压热。 (2) 系统的焓改变值ΔH等于等压热。 (3)系统的焓等于系统的热量。
答:(1)不正确。系统的焓H=U+pV。焓具有能量的单位,但其绝对值是不知道的,焓并没有明确的物理意义。因此系统的焓不等于等压热。
(2) 不正确。ΔH=Qp的条件是等压且不做其它功。符合上述条件时ΔH才等于等压热。
(3) 不正确。焓为状态函数,状态一定焓有确定值。而热是与过程有关的函数。只有ΔH(而不是H)在等压和不做其它功的条件下才等于过程的热。
.对于一定量的理想气体,温度一定时,内能与焓是否一定?是否对所有气体来说温度一定,内能与焓都一定呢?
答:对理想气体来说,其内能与焓只是温度的函数。故温度一定内能与焓就一定。其它气体内能与焓不仅是温度的函数而且是压力或体积的函数,故温度一定还要指定压力或体积内能与焓才有确定值。
.1mol理想气体从0℃恒容加热至100℃和从0℃恒压加热至100℃,ΔU是否相同?Q是否相同?W是否相同?
答:理想气体内能只是温度的函数,故ΔU是相同的。因热和功是与过程有关的,故Q和W是不相同的。恒容加热不对外做功,而恒压加热系统对外做体积功。
.一个绝热气缸有一理想绝热活塞(无磨擦、无重量),其中含有理想气体,内壁绕有电阻丝,当通电时气体就慢慢膨胀。因为是一等压过程,Qp=ΔH,又因为是绝热系统,Qp=0,所以ΔH=0。这结论对吗?
答:不对。此过程因环境对系统做了电功,故Qp≠ΔH。
.下列两个过程是否都是循环过程?
(1)由H2与O2合成水,然后再电解成H2与O2;
(2)金属铜在试管中氧化成氧化铜,然后再通入氢气,使氧化铜还原为铜(以铜为体系与以铜和氧为体系有何不同)。
答:(1)为循环过程。(2)若以铜为系统,是循环过程;若以铜和氧为系统,则不是循环系统。因为若用氢气还原,氧生成水而未能还原成氧。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
;填空题.已知反应 A(g) + B(g) → C(g)+H2O(l) 在298.15K时的恒容摩尔反应热为100kJ·mol-1 ,则在同温下该反应的恒压反应热
Qp=_ QV+SvBRT_(计算式)=_100kJ·mol-1+(-1)×8.3145×10-3kJ·K-1·mol-1×298.15K=102.5kJ·mol-1_。(2分)
.节流膨胀过程又称为 _恒焓___ 过程,多数气体经此过程后引起温度__下降_____. (2分)
.25 ℃下, 1 mol N(可视为理想气体)由 1 dm3膨胀到 5 dm3,吸热 2 kJ, 则对外作功 W = 2 kJ (按系统得功为正的规定) .
.1 mol H2(可看作理想气体)等温可逆地由 100 kPa、20 dm3压缩至 200 kPa, 终态体积 V = 10 dm3。
.化学反应的热效应变换公式 QP- QV= △nRT 的适用条件是封闭系统,非体积功为零, 反应组分中的气体为理想气体。
;计算题.在 298.15K 时,使 5.27 克的甲醇(摩尔质量为32克) 在弹式量热计中恒容燃烧,放出 119.50kJ 的热量。忽略压力对焓的影响。
(1) 计算甲醇的标准燃烧焓 △cHmq。
(2) 已知298.15K时 H2O(l) 和CO2(g)的标准摩尔生成焓分别为-285.83 kJ·mol-1 、-393.51 kJ·mol-1,计算CH3OH(l)的△fHmq 。
(3) 如果甲醇的标准蒸发焓为 35.27kJ·mol-1,计算CH3OH(g) 的 △fHmq(10分)
解:(1) 甲醇燃烧反应:CH3OH(l) +

添加图片注释,不超过 140 字(可选)
O2(g) → CO2(g) + 2H2O(l)
△ cU mq = -119.50 kJ/(5.27/32)mol = -725.62 kJ·mol-1
△cH mq = △cU mq+
= (-725.62 - 0.5×8.3145×298.15×10-3)kJ·.mol-1
= =-725.6-0.5*8.314*0.29815 \# "0.0" -726.86 kJ·mol -1
(2)△cH mq = △fH mq (CO2) + 2△fH mq(H2O ) - △fH mq [CH3OH(l)]
△fH mq[CH3OH (l)]= △fH mq (CO2) + 2△fH mq(H2O ) - △cH mq
= [-393.51+2×(-285.83) - (-726.86) ] kJ·mol-1
= =-393.51-2*285.83+726.8 -238.31 kJ·mol -1
(3)CH3OH (l) →CH3OH (g) ,△vapH mq = 35.27 kJ·.mol -1
△fH mq[CH3OH (g)]= △fH mq [CH3OH (l)] + △vapH mq = (-238.31+35.27)kJ·.mol -1
= - 203.04 kJ·mol-1
.在一定压力p和温度298.2 K的条件下,1molC2H5OH(l)完全燃烧时所做的功是多少?设体系中气体服从理想气体行为。
解:反应方程

编辑
添加图片注释,不超过 140 字(可选)
这是等温、等压下的化学反应:

编辑
添加图片注释,不超过 140 字(可选)
!第二章热力学第二定律;选择题.ΔG=0 的过程应满足的条件是
(A) 等温等压且非体积功为零的可逆过程 (B) 等温等压且非体积功为零的过程 (C) 等温等容且非体积功为零的过程
(D) 可逆绝热过程 答案:A
.在一定温度下,发生变化的孤立体系,其总熵
(A)不变 (B)可能增大或减小(C)总是减小(D)总是增大答案:D。因孤立系发生的变化必为自发过程,根据熵增原理其熵必增加。
.对任一过程,与反应途径无关的是
(A) 体系的内能变化 (B) 体系对外作的功 (C) 体系得到的功 (D) 体系吸收的热
答案:A。只有内能为状态函数与途径无关,仅取决于始态和终态。
.下列各式哪个表示了偏摩尔量:

编辑切换为居中
添加图片注释,不超过 140 字(可选)
答案:A。首先根据偏摩尔量的定义,偏导数的下标应为恒温、恒压、恒组成。只有A和D符合此条件。但D中的
不是容量函数,故只有A是偏摩尔量。
.氮气进行绝热可逆膨胀
ΔU=0 (B) ΔS=0 (C) ΔA=0 (D) ΔG=0 答案:B。绝热系统的可逆过程熵变为零。
.关于吉布斯函数G, 下面的说法中不正确的是
(A)ΔG≤W'在做非体积功的各种热力学过程中都成立
(B)在等温等压且不做非体积功的条件下, 对于各种可能的变动, 系统在平衡态的吉氏函数最小
(C)在等温等压且不做非体积功时, 吉氏函数增加的过程不可能发生
(D)在等温等压下,一个系统的吉氏函数减少值大于非体积功的过程不可能发生。答案:A。因只有在恒温恒压过程中ΔG≤W'才成立。
.关于热力学第二定律下列哪种说法是错误的
(A)热不能自动从低温流向高温(B)不可能从单一热源吸热做功而无其它变化(C)第二类永动机是造不成的(D热不可能全部转化为功
答案:D。正确的说法应该是,热不可能全部转化为功而不引起其它变化
.关于克劳修斯-克拉佩龙方程下列说法错误的是
(A) 该方程仅适用于液-气平衡 (B) 该方程既适用于液-气平衡又适用于固-气平衡
(C) 该方程假定气体的体积远大于液体或固体的体积(D) 该方程假定与固相或液相平衡的气体为理想气体 答案:A
.关于熵的说法正确的是
(A) 每单位温度的改变所交换的热为熵 (B) 可逆过程熵变为零 (C) 不可逆过程熵将增加 (D) 熵与系统的微观状态数有关
答案:D。(A)熵变的定义

添加图片注释,不超过 140 字(可选)
其中的热应为可逆热;(B)与(C)均在绝热系统中才成立。
.在绝热条件下,迅速推动活塞压缩气筒内空气,此过程的熵变
(A) 大于零 (B) 小于零 (C) 等于零 (D) 无法确定 答案:A。绝热不可逆过程熵要增加。
.氢气进行不可逆循环
ΔU>0 (B) ΔS=0 (C) ΔS>0 (D) ΔS<0 答案:B。循环过程状态函数不变。
.氢气和氧气在绝热钢瓶中生成水
(A)ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0
答案:D。绝热钢瓶中进行的反应无热交换、无体积功,即Q=W=0,故ΔU=0。此过程为绝热不可逆过程故ΔS>0。此过程恒容ΔH=ΔU+Δ(pV)=VΔp,因Δp不等于零故ΔH亦不为零。恒温、恒压不做其它的可逆过程ΔG=0,上述过程并非此过程。
. 下述过程,体系的ΔG何者为零?
(A) 理想气体的等温膨胀 (B) 孤立体系的任意过程 (C) 在100℃,101325Pa下1mol水蒸发成水汽 (D) 绝热可逆过程
答案:C。可逆相变ΔG为零。
.关于熵的性质, 下面的说法中不正确的是
(A) 环境的熵变与过程有关 (B) 某些自发过程中可以为系统创造出熵 (C) 熵变等于过程的热温商
(D) 系统的熵等于系统内各部分熵之和 答案:C。正确的说法应为熵变等于过程的可逆热温商。
.关于亥姆霍兹函数A, 下面的说法中不正确的是
(A) A的值与物质的量成正比 (B)虽然A具有能量的量纲, 但它不是能量 (C)A是守恒的参量 (D)A的绝对值不能确定 答案:C
.关于热力学基本方程dU=TdS-pdV, 下面的说法中准确的是
(A) TdS是过程热 (B)pdV是体积功(C) TdS是可逆热 (D)在可逆过程中, pdV等于体积功, TdS即为过程热 答案:D
.理想气体在自由膨胀过程中, 其值都不为零的一组热力学函数变化是
(A) ΔU、ΔH、ΔS、ΔV (B)ΔS、ΔA、ΔV、ΔG (C) ΔT、ΔG、ΔS、ΔV (D)ΔU、ΔA、ΔH、ΔV
答案:B。理想气体自由膨胀过程中不做功亦不放热,故ΔU=0,ΔT=0。
.在一绝热恒容箱中, 将NO(g)和O2(g)混合,假定气体都是理想的, 达到平衡后肯定都不为零的量是
(A) Q, W, ΔU (B) Q, ΔU, ΔH (C) ΔH, ΔS, ΔG (D) ΔS, ΔU, W
答案:C。此条件下Q、W和ΔU都为零。由ΔH=ΔU+Δ(pV)可见反应前后压力有变化故ΔH不为零,微观状态数有变化故ΔS不为零,ΔG=ΔH-Δ(TS)亦不为零。
.在下列过程中, ΔG=ΔA的是
(A) 液体等温蒸发 (B) 气体绝热可逆膨胀 (C) 理想气体在等温下混合 (D) 等温等压下的化学反应
答案:C。由ΔG=ΔA+Δ(pV)可知若Δ(pV)=0则ΔG=ΔA。
一卡诺热机在两个不同温度之间的热源之间运转, 当工作物质为气体时, 热机效率为42%, 若改用液体工作物质, 则其效率应当
(A) 减少 (B) 增加 (C) 不变 (D) 无法判断 答案:C
.理想气体绝热向真空膨胀,则
(A) dS = 0,dW = 0 (B) dH = 0,dU = 0
(C) dG = 0,dH = 0 (D) dU =0,dG =0 答案:B
. 对于孤立体系中发生的实际过程,下式中不正确的是
(A) W = 0 (B) Q = 0 (C) dS > 0 (D) dH = 0 答案:D
.理想气体经可逆与不可逆两种绝热过程,则
(A) 可以从同一始态出发达到同一终态。 (B) 不可以达到同一终态。 (C) 不能确定以上A、B中哪一种正确。
(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定。 答案:B
. 求任一不可逆绝热过程的熵变dS,可以通过以下哪个途径求得?
(A)始终态相同的可逆绝热过程。(B)始终态相同的可逆恒温过程。(C)始终态相同的可逆非绝热过程。(D) B 和C 均可。答案:C
.在绝热恒容的系统中,H2和Cl2反应化合成HCl。在此过程中下列各状态函数的变化值哪个为零?
(A) ΔrHm (B) ΔrUm (C) ΔrSm (D) ΔrGm 答案:B。因Q=0,W=0。
. 1mol Ag(s)在等容下由273.2K加热到303.2K。已知在该温度区间内Ag(s)的Cv,m=24.48J·K-1·mol-1则其熵变为:
(A)2.531J·K-1 (B) 5.622J·K-1 (C) 25.31J·K-1 (D) 56.22J·K-1
答案:A。
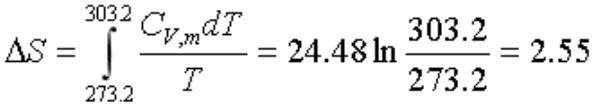
编辑
添加图片注释,不超过 140 字(可选)
.理想气体经历等温可逆过程,其熵变的计算公式是:
(A) ΔS =nRTln(p1/p2) (B) ΔS =nRTln(V2/V1) (C) ΔS =nRln(p2/p1) (D) ΔS =nRln(V2/V1) 答案:D
. 在标准压力下,90℃的液态水气化为90℃的水蒸汽,体系的熵变为:
(A)ΔS体>0 (B)ΔS体<0 (C)ΔS体=0 (D)难以确定 答案:A。液态变为气态时,混乱度增加,故熵增加。
.在101.325kPa下,385K的水变为同温下的水蒸汽。对于该变化过程,下列各式中哪个正确:
(A) ΔS体+ΔS环 > 0 (B) ΔS体+ΔS环 < 0 (C) ΔS体+ΔS环 = 0 (D) ΔS体+ΔS环的值无法确定
答案:A。因该变化为自发过程。
. 在标准压力p$和268.15K时,冰变为水,体系的熵变ΔS 体应:
(A) 大于零 (B) 小于零 (C) 等于零 (D) 无法确定 答案:A。因固体变液体混乱度增加。
.1mol理想气体从p1,V1,T1分别经:(1) 绝热可逆膨胀到p2,V2,T2;(2) 绝热恒外压下膨胀到p2′,V2′,T2′,若p2 = p2′ 则: (A)T2′= T2, V2′= V2, S2′= S2 (B)T2′> T2, V2′< V2, S2′< S2
(C)T2′> T2, V2′> V2, S2′> S2 (D)T2′< T2, V2′< V2, S2′< S2
答案:C。恒外压膨胀较可逆膨胀做出的功要少,且绝热,故过程(2)内能的减少要小一些,所以T2′> T2。终态压力相同因此V2′> V2。又根据熵增原理,可判定S2′> S2。
.理想气体在恒温条件下,经恒外压压缩至某一压力,此变化中体系的熵变ΔS体及环境的熵变ΔS环应为:
(A) ΔS体 > 0, ΔS环 < 0 (B) ΔS体 < 0, ΔS环 > 0 (C) ΔS体 > 0, ΔS环 = 0 (D) ΔS体 < 0, ΔS环 = 0
答案:B。理想气体恒温压缩混乱度减小,故熵减小;而理想气体恒温压缩时内能不变,得到的功要以热的形式释放给环境,故环境得到热ΔS环 > 0。
.理想气体在绝热条件下,经恒外压压缩至稳态,此变化中的体系熵变ΔS体及环境熵ΔS环应为:
(A) ΔS体 > 0, ΔS环 < 0 (B) ΔS体 < 0, ΔS环 > 0 (C) ΔS体 > 0, ΔS环 = 0 (D) ΔS体 < 0, ΔS环 = 0
答案:C。该过程为绝热不可逆过程,故ΔS体 > 0;又因绝热过程,故ΔS环 = 0。
.在101.3kPa下,110℃的水变为110℃水蒸气,吸热Qp,在该相变过程中下列哪个关系式不成立?
(A) ΔS体 > 0 (B) ΔS环不确定 (C) ΔS体+ΔS环 > 0 (D) ΔG体 < 0
答案:B。环境的熵变是确定的,可由ΔS环=-Qp/T来求算。
. 一个由气相变为凝聚相的化学反应在恒温恒容下自发进行,问下列各组答案中哪一个是正确的:
(A) ΔS体 > 0, ΔS环 < 0 (B) ΔS体 < 0, ΔS环 > 0 (C) ΔS体 < 0, ΔS环 = 0 (D) ΔS体 > 0, ΔS环 = 0
答案:B。反应由气相变为凝聚相熵减少,ΔS体 < 0;自发过程的总熵变应增加,故ΔS环 > 0。
.263K的过冷水凝结成263K的冰,则:
(A)ΔS < 0 (B)ΔS > 0 (C) ΔS = 0 (D) 无法确定 答案:A。恒温下液体变固体熵减少。
.理想气体由同一始态出发,分别经(1)绝热可逆膨胀;(2)多方过程膨胀,达到同一体积V2,则过程(1)的熵变ΔS(1)和过程(2)的熵变ΔS(2)之间的关系是:
(A)ΔS(1) > ΔS(2) (B)ΔS(1) < ΔS(2) (C)ΔS(1) = ΔS(2) (D)两者无确定关系
答案:B。绝热可逆过程ΔS=0,多方过程体积膨胀ΔS>0。
.从多孔硅胶的强烈吸水性能说明在多孔硅胶吸水过程中,自由水分子与吸附在硅胶表面的水分子比较,两者化学势的高低如何? (A) 前者高 (B) 前者低 (C) 相等 (D) 不可比较
答案:A。化学势决定物质流动的方向,物质由化学势高的流向低的,自由水分子在多孔硅胶表面的强烈吸附表明自由水分子的化学势高。
.理想气体从状态I经自由膨胀到状态II,可用哪个热力学判据来判断该过程的自发性?
(A)ΔH (B) ΔG (C)ΔS隔离 (D) ΔU 答案:C。理想气体自由膨胀不做功,亦不换热,故为隔离系统。
.理想气体从状态p1,V1,T 等温膨胀到p2,V2,T,此过程的ΔA 与ΔG 的关系为
(A)ΔA>DG (B)ΔA<ΔG (C)ΔA=ΔG (D)无确定关系 答案:C。因G=H-TS,A=U-TS,G-A=pV,ΔG-ΔA=nRΔT=0。
.在标准压力pº下,383.15K的水变为同温下的蒸汽,吸热Qp 。对于该相变过程,以下哪个关系式不能成立?
(A) ΔG<0 (B)ΔH=Qp (C)ΔS隔离<0 (D)ΔS隔离>0 答案:C。隔离系统的熵不可能减少。
. 对临界点性质的下列描述中,哪一个是错误的:
(A)液相摩尔体积与气相摩尔体积相等 (B)液相与气相的界面消失 (C)气化热为零 (D)固,液,气三相共存 答案:D
.下述说法中哪一个正确?当温度恒定时:
(A)增加压力有利于液体变为固体 (B)增加压力不利于液体变为固体
(C)增加压力不一定有利于液体变为固体 (D)增加压力与液体变为固体无关 答案:C
.对于平衡态的凝聚相体系,压力p表示什么含义?
(A) 101.3kPa (B) 外压
(C)分子间引力总和 (D)分子运动动量改变的统计平均值 答案:B
. 在α,β两相中均含有A和B两种物质,当达到平衡时,下列种哪情况是正确的:
答案:B
. 在273.15K,2p°时,水的化学势与冰的化学势之间的关系如何:
(A) 前者高 (B) 前者低 (C) 相等 (D) 不可比较 答案:B
.单一组分的过冷液体的化学势比其固体的化学势:
(A) 高 (B) 低 (C) 相等 (D) 不可比较 答案:A
.已知水的下列5种状态:
(1) 373.15K, p$, 液态 (2) 373.15K, 2 p$, 液态 (3) 373.15K, 2 p$, 气态
(4) 374.15K, p$, 液态 (5) 374.15K, p$, 气态
下列4组化学势的比较中,哪个不正确?
(A)μ2 >μ1 (B)μ5 >μ4 (C)μ3 >μ5 (D)μ3 >μ1 答案:B
. 等温等压下,在A和B组成的均相体系中,若A的偏摩尔体积随浓度的改变而增加,则B的偏摩尔体积将:
(A) 增加 (B) 减小 (C) 不变 (D) 不一定 答案:B(根据吉布斯-杜亥姆方程判断)
. 恒温时B溶解于A形成溶液。若纯B的摩尔体积大于溶液中B的偏摩尔体积,则增加压力将使B在A中的溶解度:
(A) 增加 (B)减小 (C) 不变 (D) 不确定
答案:A(

添加图片注释,不超过 140 字(可选)
可知增加压力,纯B的化学势增加的更多,则纯B的化学势将大于溶液中B的化学势,因此B的溶解度增大)
.热力学第三定律可以表示为:
(A)在0K时,任何晶体的熵等于零 (B)在0K时,任何完整晶体的熵等于零
(C)在0℃时,任何晶体的熵等于零 (D)在0℃时,任何完整晶体的熵等于零 答案:B
;问答题.理想气体恒温膨胀做功时ΔU=0,故Q=-W,即所吸之热全部转化为功。此与Kelvin说法有否矛盾?
答:不矛盾。Kelvin的说法是:“不可能从单一热源吸热使之全部转化为功而不引起其它变化”。本例中,虽然热全部转化为功但却引起了系统的体积的变化。
.孤立系统从始态不可逆进行到终态ΔS>0,若从同一始态可逆进行至同一终态时ΔS=0。这一说法是否正确?
答:不正确。熵是状态函数与变化的途径无关,故只要始态与终态一定ΔS必有定值。孤立体系中的不可逆过程ΔS>0而可逆过程ΔS=0是勿庸置疑的。问题是孤立体系的可逆过程与不可逆过程若从同一始态出发是不可能达到相同终态。
.有人认为理想气体向真空膨胀是等熵过程。因为理想气体向真空膨胀时温度不变,故dU=0;对外不做功,故pdV=0。所以由dU=TdS-pdV可得TdS=0。因T≠0,故dS=0。这样的分析正确吗?
答:不正确。因为在dU=TdS-pdV中p指系统自身的压力,而膨胀功等于零是指p(外)dV=0。本例中p(外)≠p,所以pdV≠0,因此dS≠0。上述过程不是等熵过程。
.理想气体向真空膨胀是恒温过程,它的ΔS可通过设计一个在相同的始态和终态下的恒温可逆过程来计算。理想气体向真空膨胀又是绝热过程,那么它的ΔS是否也可通过设计一个在相同的始态和终态下的绝热可逆过程来计算呢?
答:不可以。因为理想气体向真空膨胀是绝热不可逆过程,它与绝热可逆膨胀不可能达到同一终态。这是因为理想气体向真空膨胀时温度不变,而绝热可逆膨胀时对外做功消耗内能从而温度下降。
.dU=TdS-pdV得来时假定过程是可逆的,为什么也能用于不可逆的pVT变化过程?
答:因为在简单的pVT变化过程中,系统的状态只取决于两个独立的强度变量。当系统从状态1变化至状态2时,状态函数U、S、V的改变就是定值。
.dG=-SdT+Vdp那么是否101.325kPa、-5℃的水变为冰时,因dT=0、dp=0,故dG=0?
.冰在273K下转变为水,熵值增大,则ΔS=(Q/T)>0。但又知在273K时冰与水处于平衡状态,平衡条件是dS=0。上面的说法有些矛盾,如何解释?
答:孤立系统的平衡条件是dS=0。上述过程非孤立系统,故熵值理应增大。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
;是非题.( )能发生的过程一定是自发过程。
.( )功可以全部转变成热,但热一定不能全部转化为功。
.( )从单一热源吸取热量而全部变为功是可能的。
.( )家里没有空调,可以打开冰箱门来代替空调达到降温的目的。
.( )所有绝热过程的Q为零,△S也必为零。
.( )熵值不可能为负值。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.( )ΔrGm>0的反应,是不可能进行的反应。
;填空题.一个过程系统的熵变为△S, 而另一个过程的始终态与前过程相同,但路径不同,则此过程系统的熵变应为__△S___。(1分)
因为状态函数与过程无关
.0 ℃, 101.3 kPa下, 1 mol冰熔化成水, 吸热 6.02 kJ,此过程 △G =0.
.液体水在100℃,

添加图片注释,不超过 140 字(可选)
下气化为水蒸气,此过程的
ΔU > 0,ΔH > 0,ΔS= > 0,ΔG = 0
(填“>”、“<”或“=”
.101.3 kPa下, 1 kg 100 ℃的水蒸气冷凝为同温度下的水,此过程 △S(系统)
<0, △S(总) =0 ( 填 >, < 或 = ).
;计算题.(15分)101.3 kPa下, 1 mol的 100 ℃水与 100 ℃的大热源相接触, 经过两种不同的过程到达终态 100 ℃, 101.3 kPa的水蒸气: (1)保持压力不变; (2)向真空膨胀.试分别计算这两种过程的 Q, W,△U,△H,△S,△A及△G 并判断过程是否可逆.已知 100℃,101.3 kPa下水的气化热△vapHΘm = 40.71 kJ.mol-1, V(l) = 18.8×10-6 m3.mol-1, V(g) = 3.02×10-2 m3.mol-1.
解: (1) W = - △V = - 101.3×103×(3.02×10-2-18.8×10-6) = - 3.06 kJ
Q = △H = 40.71 kJ
△U = Q + W = 40.71 - 3.06 = 37.65 kJ
△S = Q/T = 40.71×10-3/373 = 109.1 J.K
△A = △U - T△S = 37.65 - 40.71 = - 3.06 kJ
△G = 0
∵ 在沸点下蒸发,故为可逆过程.由 △G = 0 也可判断.
(2) W =0
△U = 37.65 kJ △H = 40.71 kJ △S = 109.1 J.K △A = - 3.06 kJ △G = 0
Q =△U-W=37.65 kJ
△S(环) = - Q/T = - (△U-W)/T = - 37.65×10-3/373 = - 100.9 J.K
△S(总) = △S + △S(环) = 109.1 - 100.9 = 8.2 J.K-1 > 0 过程(2)为不可逆过程.

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.1mol 理想气体从300K ,100kPa下等压加热到600K,求此过程的Q、W、DU、DH、DS、DG。已知此理想气体300K时的Smq=150.0J·K-1·mol-1,cp,m=30.00 J·K-1·mol-1。(10分)
1.解:W=-pDV=-p(V2-V1) =-pV2+pV1= -nRT2+ nRT1= nR(T1-T2)
=1mol×8.315J·K-1·mol-1×(300K-600K)= -2494.5J
DU= nCV,m (T2-T1) =1mol×(30.00-8.315)J·K-1·mol-1×(600K-300K)= 6506J
DH= nCp,m (T2-T1) =1mol×30.00J·K-1·mol-1×(600K-300K)= 9000J
Qp= DH =9000J
DS = nCp,m ln(T2/T1) =1mol×30.00J·K-1·mol-1×ln(600K/300K)
= 20.79J·K-1·mol-1
由 Smq(600K)=Smq(300K)+DS=(150.0+20.79)J·K-1·mol-1
=170.79J·K-1·mol-1
DTS =n(T2S2-T1S1)
=1mol×(600K×170.79J·K-1·mol-1-300K×150.0J·K-1·mol-1)
=57474J
DG= DH-DTS=9000J-57474J =-48474J
.在一杜瓦瓶(绝热恒压容器)中 ,将 5 摩尔 40℃ 的水与 5 摩尔0℃的冰混合,求平衡后的温度,以及此系统的 △H 和 △S。已知冰的摩尔熔化焓为 6024 J·mol -1,水的等压摩尔热容为 75.3 J·K-1·mol-1。(10分)
解: 系统恒压绝热且不做非体积功,过程 △H = Qp =0
若冰全部熔化 △H1 = n△熔化Hm = 5mol×6024J·mol-1 = 30120 J,
水降温到0℃时 △H2= nCp,m(T2 - T1) = 5mol×75.3J·K·mol-1×(-40K) = -15060J
因△H1+△H2 = 15060 J >0 , 故冰不会全熔化, 系统温度为0℃。
( 或者假设冰全部熔化并升温至t. 根据△H=0, 可算出t<0,故合理值应为0)。
设冰的熔化量为n mol,过程的变化如下:

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.将装有0.2 mol乙醚的微小玻璃泡放入308.15K、20 dm3的恒温密闭容器内,容器内充满100kPa、x mol氮气。将小泡打碎,乙醚完全汽化并与氮气混合。已知乙醚在100 kPa下沸点为308.15K,此时的蒸发焓为25.10 kJ·mol-1。试求
(1) 混合气体中乙醚的分压;
(2) 分别计算氮气和乙醚的△H、△S、△G。 (10分)

编辑切换为居中
添加图片注释,不超过 140 字(可选)
.在一个装有理想活塞的导热气缸中, 含有100℃、总压140kPa的氮气与水蒸气的混合气体0.400m3,氮的摩尔分数y(N2)=0.45. 今将该混合气体恒温可逆压缩到201.325kPa. 试求此过程的Q、W、△U、△H、△S、△A、△G。
已知水在100℃、101.325 kPa下的摩尔气化焓为40.67kJ/mol, 气体为理想气体,末态水的体积相对于气体的体积可忽略不计,且不考虑N2在水中的溶解。(12分)

编辑切换为居中
添加图片注释,不超过 140 字(可选)
= -238.86 J.K-1
△G=△H - T△S =[ -69.03 -373.15*(-0.23886) ] kJ =20.10 kJ
△ A=△U - T△S = [ -63.76 -373.15*(-0.23886) ] kJ =25.37 kJ
过程恒温可逆:
Q = T△S = 373.15*(-0.23886) kJ =-89.13 kJ W=△U - Q = -63.76 kJ +89.13 kJ = 25.37 kJ
.(15分)1 mol单原子分子理想气体,初态为 25 ℃, 202.6 kPa: (1)向真空膨胀至体积为原来的2倍;(2)可逆绝热膨胀到 - 86 ℃.分别计算这两种过程的 W, Q,△U,△H,△S及△G(已知初态时该气体的摩尔熵 Smq= 163.8 J.K.mol).
解:(1) W = Q = △U = △H = 0
△S = nR ln ( V2/V1) = 1×8.314×ln (2V/V) = 5.76 J.K
△G =△H - T△S = 0 - 298×5.76 = - 1717J = - 1.72 kJ
(2) Q = 0
△U = nCv( T2- T1)= (3/2)×8.314×(187-298) = - 1384 J = - 1.38 kJ
W = △U = - 1.38 kJ
△H = nCp( T2-T1)= (5/2)×8.314×(187-298) = - 2307 J = - 2.31 kJ
△S = 0 , △G = △H - ( T2S2- T1S1) =△H - S△T= - 2307 - 163.8×(187 - 298) = 15875 J = 15.9 kJ
.(20分) 5mol过冷水在-5℃, 101.3kPa下凝结为冰,计算过程的ΔG, 并判断过程在此条件下能否发生。已知水在0℃, 101.3kPa下凝固热ΔHm,凝=-6.009J·K-1·mol-1,水的平均热容为75.3 J·K-1·mol-1, 冰的平均热容为37.6 J·K-1·mol-1。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
理想气体恒温过程 DH2=0, DU2=0

编辑切换为居中
添加图片注释,不超过 140 字(可选)
DH= DH1+ DH2= DH1=40.59 kJ (2分)
DU= DU1+ DU2= DU1= DH1–D(pV)= DH1–RT=37.47 kJ (2分)
因对整个容器系统 DV=0,故W=0,Q= DU = 37.47 kJ (2分)
DS= DS1+ DS2= DH1/T – nRln(p2/p1) =118.60 J·K–1 (2分)
DA= DU –TDS=37.49kJ –118.60´373.15 J = –6.771 kJ (1分)
DG= DH –TDS=40.59kJ –118.60´373.15 J = –3.672 kJ (1分)
!第三章多组分系统热力学;选择题.在373.15K和101325Pa下水的化学势与水蒸气化学位的关系为
(A) μ(水)=μ(汽) (B) μ(水)<μ(汽) (C) μ(水)>μ(汽) (D) 无法确定 答案:A。两相平衡,化学势相等。
.下列哪种现象不属于稀溶液的依数性
(A) 凝固点降低 (B)沸点升高 (C) 渗透压 (D)蒸气压升高 答案:D。稀溶液的依数性之一为蒸气压下降。
.98K时,A、B两种气体在水中的亨利常数分别为 k1和 k2,且k1> k2,则当P1=P2时,A、B在水中的溶解量C1 和 C2 的关系为
(A) C1> C2 (B) C1< C2 (C) C1= C2 (D) 不能确定 答案:B
.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起
(A) 沸点升高 (B)熔点升高(C)蒸气压升高(D)都不对 答案:A。稀溶液的依数性包括沸点升高、凝固点下降、蒸气压下降和渗透压。
. 涉及纯物质标准状态的下列说法中不正确的是
(A)纯理想气体的标准状态就是标准压力P(100KPa)下的状态 (B)纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体
(C)纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体
(D)不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同 答案:D
. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是
(A) 只有溶质不挥发的稀溶液才有这些依数性 (B) 所有依数性都与溶液中溶质的浓度成正比
(C) 所有依数性都与溶剂的性质无关 (D) 所有依数性都与溶质的性质有关 答案:B
.关于亨利系数, 下面的说法中正确的是
(A) 其值与温度、浓度和压力有关 (B) 其值只与温度、溶质性质和浓度标度有关
(C) 其值与溶剂性质、温度和浓度大小有关 (D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关 答案:D
.定义偏摩尔量时规定的条件是
(A) 等温等压 (B) 等熵等压 (C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变 答案:D
.关于偏摩尔量, 下面的说法中正确的是
(A) 偏摩尔量的绝对值都可求算 (B) 系统的容量性质才有偏摩尔量
(C) 同一系统的各个偏摩尔量之间彼此无关 (D) 没有热力学过程就没有偏摩尔量 答案:B
.关于偏摩尔量, 下面的叙述中不正确的是
(A) 偏摩尔量是状态函数, 其值与物质的数量无关 (B) 系统的强度性质无偏摩尔量
(C) 纯物质的偏摩尔量等于它的摩尔量 (D) 偏摩尔量的数值只能为整数或零 答案:D
.影响沸点升高常数和凝固点降低常数值的主要因素是
(A)溶剂本性 (B)温度和压力(C溶质本性 (D)温度和溶剂本性 答案:A。由沸点升高常数
可以看出。
. 涉及稀溶液依数性的下列表述中不正确的是
(A) 在通常实验条件下依数性中凝固点降低是最灵敏的一个性质 (B) 用热力学方法推导依数性公式时都要应用拉乌尔定律
(C) 凝固点公式只适用于固相是纯溶剂的系统 (D) 依数性都可以用来测定溶质的相对分子量 答案:A
. 在等质量的水、苯、氯仿和四氯化碳中分别溶入100g非挥发性物质B,已知它们的沸点升高常数依次是0.52, 2.6, 3.85, 5.02,溶液沸点升高最多的是
(A) 氯仿 (B) 苯 (C) 水 (D)四氯化碳 答案:D。由沸点升高公式
可以看出。
. 涉及溶液性质的下列说法中正确的是
(A) 理想溶液中各组分的蒸气一定是理想气体 (B) 溶质服从亨利定律的溶液一定是极稀溶液
(C) 溶剂服从拉乌尔定律, 其蒸气不一定是理想气体 (D) 溶剂中只有加入不挥发溶质其蒸气压才下降 答案:C
. 两液体的饱和蒸汽压分别为p*A,p*B ,它们混合形成理想溶液,液相组成为x,气相组成为y,若 p*A > p*B , 则:
(A)yA > xA (B)yA > yB (C)xA > yA (D)yB > yA 答案:A
.已知373K时液体A的饱和蒸气压为133.24kPa,液体B的饱和蒸气压为66.62kPa。设A和B形成理想溶液,当溶液中A的物质的量分数为0.5时,在气相中A的物质的量分数为:
(A)1 (B) 1/2 (C) 2/3 (D) 1/3 答案:C
. 298K时,HCl(g,Mr=36.5)溶解在甲苯中的亨利常数为245kPa·kg·mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:
(A) 138kPa (B) 11.99kPa (C) 4.9kPa (D) 49kPa
.真实气体的标准态是:
(A) f = p$ 的真实气体 (B) p = p$ 的真实气体
(C) f = p$ 的理想气体 (D) p = p$ 的理想气体 答案:D
.下述说法哪一个正确? 某物质在临界点的性质
(A) 与外界温度有关 (B) 与外界压力有关
(C) 与外界物质有关 (D) 是该物质本身的特性 答案:D
.今有298K,p$ 的N2[状态I]和323K,p$ 的N2[状态II]各一瓶,问哪瓶N2的化学势大?
(A) μ(I)>μ(II) (B) μ(I)<μ(II)
(C) μ(I)=μ(II) (D) 不可比较 答案:A。因为
,S>0故温度升高Gibbs函数下降。
. 在298K、p$下,两瓶含萘的苯溶液,第一瓶为2dm3 (溶有0.5mol萘),第二瓶为1dm3 (溶有0.25mol萘),若以μ1和μ2 分别表示两瓶中萘的化学势,则
(A)μ1 = 10μ2 (B)μ1 = 2μ2 (C)μ1 = 1/2μ2 (D)μ1 = μ2 答案:D。化学热仅与浓度有关,而与物质量的多少无关。
.298K,pÆ 下,苯和甲苯形成理想液体混合物,第一份溶液体积为2dm3,苯的物质的量为0.25,苯的化学势为μ1,第二份溶液的体积为1dm3,苯的物质的量为0.5,化学势为μ2, 则
(A) μ1 >μ2 (B)μ1 < μ2 (C)μ1 = μ2 (D) 不确定 答案:B。由
知浓度高者化学势大。
.有下述两种说法:
(1) 自然界中,风总是从化学势高的地域吹向化学势低的地域 (2) 自然界中,水总是从化学势高的地方流向化学势低的地方
上述说法中,正确的是:
(A)(1) (B)(2) (C)(1)和(2) (D)都不对 答案:A
. 2mol A物质和3mol B物质在等温等压下混和形成液体混合物,该系统中A和B的偏摩尔体积分别为1.79´ 10-5m3·mol-1, 2.15´ 10-5m3·mol-1, 则混合物的总体积为:
(A) 9.67´10-5m3 (B)9.85´10-5m3 (C)1.003´10-4m3 (
相关文章
版权声明:部分内容为互联网整合,文中观点不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件举报,一经查实,本站将立刻删除。
为您推荐
2020成考高起点语文选择题_2020年成人高考高起点语文试卷
2022年高考于7日拉开帷幕。印刻时代记忆、承载个人体验的高考作文题依然备受瞩目。7日上午举行的高考语文考试共有7套试卷,其中教
07-23
精品文章
热门推荐